
Unique Autopure 蛋白纯化系统
离子交换剂是由不溶于水的网状结构高分子聚合物骨架构成,骨架 上有许多共价结合的带电基团,如果侧链是带正电基团,就可与带 负离子相结合,称为阴离子交换剂,吸附带负电蛋白质。如果侧链是带负电的基团,则称为阳离子交换剂。强离子 交换树脂在宽 pH范围内保持离子化,而弱离子交换树脂只在窄 pH 值内离子化。
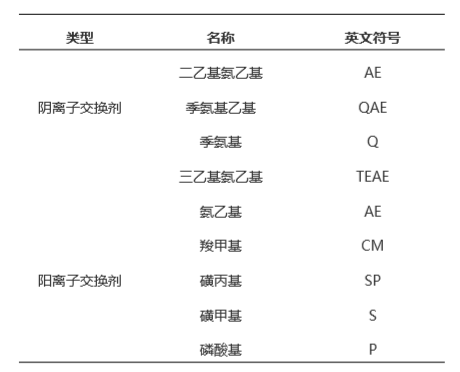
绝大多数重组蛋白纯化都要用到离子交换。离子交换色谱的基础是高分辨率,可以直接放大规模应用在工业上,柱再生容易,还可以使蛋白浓缩。大多数蛋白质的静电荷是负值,因此阴离子交换色谱的应用最为广泛。
实验设计
介质的选择
离子交换介质首先要考虑目的分子的大小,因为目的分子会影响其接近介质上的带电功能集团,因此也会影响介质对目的分子的动力载量,从而影响其分离。
对于大多数纯化步骤来说,建议从开始的阶段使用强离子交换柱,可在摸索方法的过程中有一个宽的pH 范围。对于已知等电点的蛋白质,可根据其等电点来选择。而未知等电点的蛋白质,在实际操作中常采用这样的方法,先选择一个阴离子交换剂,再选择一个中性的pH 缓冲液,将蛋白质样品透析至 pH7.0,然后过阴离子交换柱。根据过柱后的结果确定下一个使用的缓冲液 pH。
流动相的选择
离子交换色谱的流动相必需是有一定离子强度的并对pH 有一定缓冲能力的溶液。为了避免目的蛋白失活,使用缓冲液可稳定流动相的pH,使之在色谱过程中不发生明显变化,同时可稳定目的分子上的电荷量,保证色谱结果的重要性。
选择缓冲液一般按照以下原则:阳离子交换剂应选用阴离子缓冲液,可用柠檬酸盐、磷酸盐、醋酸盐、甘氨酸盐等;
阴离子交换剂应选用阳离子缓冲液,可用烷基胺、Tris、氨基乙醇胺、乙二胺、咪唑等;起始缓冲液的浓度应尽可能低(<100mmol/L)这样可以使色谱柱上更多的吸附分离物质;缓冲液应不含会影响被分离物质活性和溶解度成分,洗脱时尽量不采用 pH梯度洗脱。
色谱柱的选择
离子交换色谱通常选用粗短柱,即高径比小的色谱柱。典型的离子交换柱高度在5~20cm,高径比一般小于5。如果需要增加离子交换剂的体积,只能从增加柱的直径而不能增加其高度。如果是连续梯度洗脱,可以适当增加柱的长度。
案例介绍
离子交换是蛋白纯化中的重要手段,即可以用于捕获阶段,也可以用于精纯阶段。
预处理和装柱
1. 将超纯水与沉降胶按1:3 比例悬浮,轻轻搅匀;
2. 将色谱柱固定到设备支架上,链接出口管道,从柱底端进口反向泵入超纯水,排除管道及筛板中的气泡,停泵,
然后从出口端放出部分超纯水,保留1~2cm 高度超纯水,封死出口端,然后正向冲洗进口端管道和适配器,
排除筛板和管道中气泡;
3. 通过玻璃棒引流将悬浮胶导入色谱柱,在柱上端补充部分超纯水,搅匀,装上适配器;
4. 将柱出口端与色谱设备连接,以0.2MPa恒压装柱,装填至恒定的柱床高度,标记柱床胶面位置,关闭泵,松
开适配器,降低适配器至胶面下 2mm处,继续装填,待柱床高度稳定后,标记柱床胶面位置,降低适配器至
柱上标记柱床位置下2mm。固定适配器,继续装填2~3柱体积;
5. 确定柱体积,测量柱高,计算柱体积及记录装柱时的最大流速;
6. 选择最佳线速,用 0.5mol/L NaOH 冲洗柱,冲洗 3~5体积;
7. 接着用超纯水冲柱,冲洗10 柱体积,至pH显示接近超纯水 pH。
柱的平衡
20mmol/L 磷酸盐缓冲液,pH6.5,用 10柱体积平衡缓冲液平衡柱子,直至 pH及电导率监控显示与平衡缓冲液
的pH 及电导一致。
加样
根据柱体积及装柱的最大流速确定上样流速,上样流速不超过装柱最大流速的 75%,同时,上样流速也要尽可能低,
保证样品和介质充分发生作用。
洗脱
上样结束后,用平衡缓冲液冲洗 1~2柱体积,使UV280 响应信号重新回到基线。
之后用含有0.5mol/L NaCL的溶液洗脱,冲洗 2~3柱体积,收集色谱峰。
常见问题分析
一、纯化后样品纯度不高怎么办?
1. 若目标蛋白和杂蛋白等电点差异较大,目标蛋白通过穿透步骤获得,通过调节起始缓冲液pH,使目标蛋白与填料之间的静电作用更强;
若目标蛋白和杂蛋白等电点差异较小,目标蛋白通过洗脱步骤获得,过调节起始缓冲液pH,使目标蛋白与填料之间的静电作用更强;再调节洗脱溶液的离子强度和 pH,使目标蛋白与杂蛋白逐渐分离;
选择合适的离子交换填料及粒径;
柱没有经过起始缓冲液的充分平衡;
降低洗脱流速;
调整样品溶液黏度。
二、纯化后的蛋白收率较低怎么办?
调整样品 pH,使样品 pH与起始缓冲液 pH保持一致;
改变洗脱模式,如将线性梯度模式改变为阶段性梯度洗脱;
改变洗脱方法,如将pH 洗脱方法改为盐梯度洗脱方法;
改变洗脱强度。
三、样品过于粘稠怎么处理?
样品过于粘稠可能是由于含有的蛋白太多,或者含有大分子量的核酸分子,通常有以下解决方法:
增加裂解前稀释细胞所用体积;
增加裂解时间,直至黏度下降,或者增加 Dnase 和Mg2+的剂量;
增加机械裂解细胞的效率;
降低上样流速。